Elle touche de plus en plus de personnes âgées de 30 à 40 ans. La thérapie ciblée contre les gliomes change les règles du jeu et la vie quotidienne des patients.
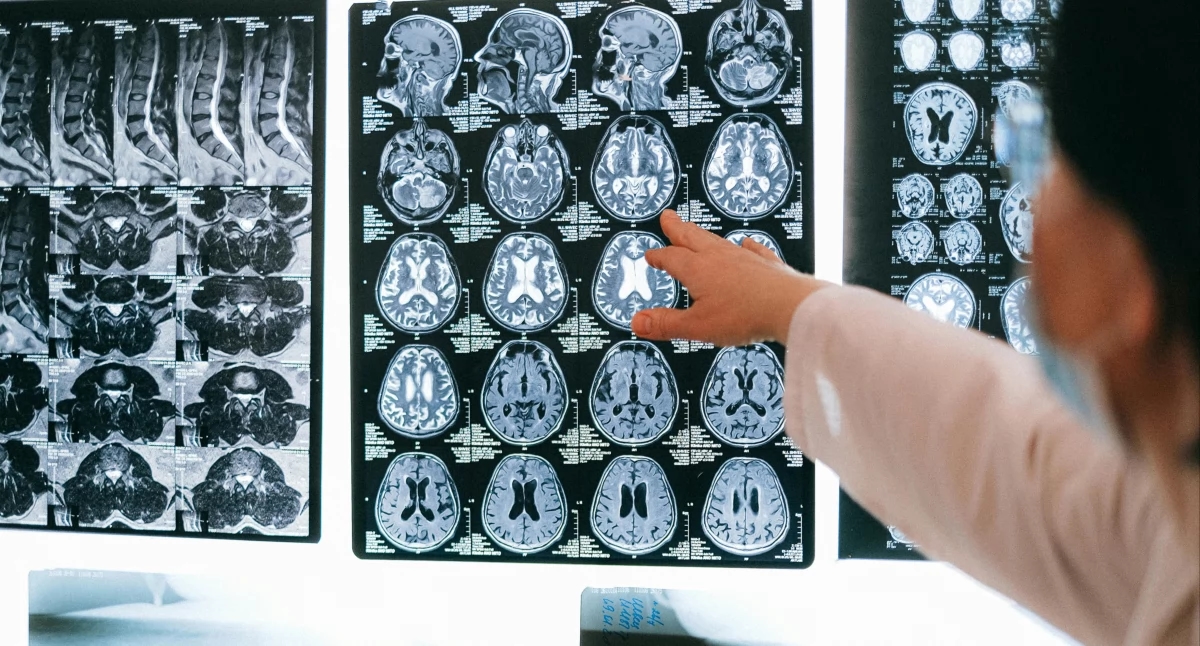
Depuis plus de deux décennies, le traitement de nombreux patients atteints de gliome est resté le même : chirurgie, suivie d'un choix difficile entre radiothérapie et chimiothérapie, avec tous ses effets secondaires et ses inquiétudes concernant les fonctions cognitives. Aujourd'hui, une pièce manquante s'est ajoutée au puzzle : la thérapie ciblée pour les patients porteurs de la mutation IDH. Les cliniciens soulignent que, pour la première fois depuis 25 ans, nous disposons d'un médicament qui ralentit réellement la progression de la maladie, permet de reporter des interventions plus complexes et offre aux patients une chance de se projeter dans l'avenir.
Paweł a 44 ans, il est programmeur, marié et père d'une fille en CE1. Son histoire a commencé brutalement, avec une crise d'épilepsie. À l'hôpital, un scanner et une IRM ont révélé une lésion après injection de produit de contraste, et le neurochirurgien a décidé de l'opérer.
La majeure partie de la tumeur a été retirée, mais un fragment a été conservé pour éviter d'endommager les centres moteurs et de déglutition. Ce diagnostic a des conséquences directes sur notre vie. Nous devons réorganiser notre quotidien, notre travail et notre façon de penser l'avenir », explique Paweł .
Après le traitement, il a repris ses activités, mais il planifie soigneusement chaque étape.
Maintenant que je me sens bien, je veux faire le maximum : travailler, être avec ma famille, voyager. Ma perspective change. La vie est plus intense, mais plus raisonnable », ajoute la patiente .
Des histoires comme celle-ci ne sont pas rares. De plus en plus souvent, des personnes trentenaires et quadragénaires reçoivent un diagnostic de gliome : elles sont actives, ont de jeunes enfants et ont des projets d'avenir. C'est une maladie rare, mais elle représente un lourd fardeau social.
Voir aussi :Les gliomes sont les tumeurs cérébrales malignes primitives les plus fréquentes chez l'adulte. Les symptômes varient selon la localisation et la vitesse de croissance, allant des céphalées et troubles visuels à la parésie et aux troubles de l'élocution. Chez les patients plus jeunes , les convulsions sont souvent le premier symptôme ; elles touchent jusqu'à 70 % des patients et peuvent altérer le fonctionnement quotidien, y compris professionnel.
Pendant des années, le traitement a été limité par la barrière hémato-encéphalique , qui entravait l'administration du médicament à la tumeur, et par sa croissance diffuse, qui empêchait une résection complète. La neurochirurgie, complétée par la radiothérapie et la chimiothérapie, est restée la norme, souvent au prix d'une neurotoxicité.
Un tournant a été la découverte du rôle des mutations du gène IDH (IDH1/IDH2), dites « driver ». L'enzyme altérée favorise l'accumulation d'oncométabolites, perturbe la maturation cellulaire et stimule la tumorigenèse. Inhiber ce processus est logique sur les plans biologique et clinique. La nouvelle classification de l'OMS (2021) et les recommandations soulignent la nécessité des tests moléculaires , car c'est la biologie , et non l'image microscopique seule, qui détermine le pronostic et les options thérapeutiques .
L' étude INDIGO , randomisée et en double aveugle, a recruté des patients porteurs de mutations IDH1/IDH2 et d'une maladie résiduelle visible après un traitement neurochirurgical. Un nouveau médicament oral, le vorasidenib , un inhibiteur des enzymes IDH1 et IDH2 mutantes qui traverse la barrière hémato-encéphalique, a été comparé à un placebo en l'absence de protocole de soins standard efficace.
Une évaluation radiologique indépendante a démontré une amélioration significative de la survie sans progression : une médiane d’environ 27,7 mois contre 11,1 mois ; une réduction du risque d’environ 39 % par rapport à la valeur initiale . L’allongement du délai avant intervention ultérieure ( chirurgie, radiothérapie ou chimiothérapie) a également été important, procurant aux patients une réelle tranquillité d’esprit thérapeutique. Une réduction du volume tumoral a également été observée chez certains patients, ainsi qu’une diminution de la fréquence des crises et un maintien de la qualité de vie mesuré par des questionnaires standardisés. Le profil de sécurité a été jugé favorable et généralement modéré.
Les gliomes sont une maladie incurable, mais ils peuvent être traités et leur progression retardée, et chez certains patients, ils peuvent conduire à une évolution chronique, souligne le professeur Rafał Stec , chef de la clinique d'oncologie de l'Université de médecine de Varsovie.
En septembre, le vorasidenib a été approuvé dans l'Union européenne, après avoir reçu le statut de thérapie révolutionnaire de la FDA et avoir été inclus dans les dernières directives du NCCN (2025) .
Voir aussi :L'objectif reste une résection aussi sûre que possible , appuyée par une cartographie des fonctions motrices et de la parole et par fluorescence. Cependant, ce n'est que le début, et non la fin, du processus décisionnel. La biologie de la tumeur et la consultation d'une équipe pluridisciplinaire (neurochirurgien, oncologue clinicien, radiothérapeute, neuropathologiste, neuroradiologue, épileptologue, neuropsychologue et, tout aussi important, le patient) déterminent la suite du traitement .
La chirurgie est la méthode principale, mais elle ne permet pas à elle seule une guérison définitive. Nous nous efforçons d'obtenir la résection la plus importante possible, sans pour autant compromettre un déficit permanent. Nous savons que l'étendue de la résection influence la survie, mais elle ne peut jamais être une fin en soi », rappelle le professeur Tomasz Dziedzic de la clinique de neurochirurgie pédiatrique de l'université de médecine de Varsovie.
Pour de nombreux patients, préserver leur emploi, leur mémoire, leur langage et leurs responsabilités familiales est aussi important que les résultats d'imagerie. Les thérapies conventionnelles comportent un risque de déficits cognitifs permanents et d'exclusion professionnelle. Dans l'essai clinique INDIGO , la thérapie ciblée n'a pas aggravé les fonctions neurocognitives et a permis de reporter les interventions présentant une toxicité plus élevée.
« Le traitement ne peut pas être pire que la maladie. Il faut peser l'efficacité par rapport à la toxicité et à l'impact sur le fonctionnement du patient », souligne le professeur Rafał Stec .
C’est pourquoi l’histoire de Paweł sur son retour au travail, l’entretien de son jardin et ses projets de voyage est si importante aujourd’hui.
La condition préalable est une mutation du gène IDH et une modification résiduelle après la chirurgie , et c'est précisément dans ce cas que l'étude a démontré son efficacité. Lorsqu'il n'y a pas de besoin urgent de radiothérapie ou de chimiothérapie, une fenêtre thérapeutique s'ouvre pour un traitement moléculaire ciblé. Les décisions sont prises en comité, et le patient a le droit de comprendre et de participer au processus décisionnel, ce qui justifie le choix d'une voie et le report d'une autre.
Après un quart de siècle, nous disposons d'un traitement systémique peu toxique qui traverse la barrière hémato-encéphalique, cible un mécanisme pathologique spécifique et contribue à maintenir la qualité de vie . C'est ainsi qu'agit le vorasidenib , un médicament à ciblage moléculaire destiné aux patients atteints d'astrocytome ou d'oligodendrogliome porteurs de mutations IDH1 et IDH2 . Selon les indications actuelles, il peut être utilisé chez les adultes et les adolescents à partir de 12 ans (≥ 40 kg) après une intervention chirurgicale lorsqu'une radiothérapie/chimiothérapie immédiate n'est pas nécessaire.
Selon les experts, la clé pour améliorer les résultats du traitement systémique des tumeurs du système nerveux central reste la personnalisation de la thérapie, en tenant compte du profil moléculaire et génétique de la tumeur.
Source : documents de presse Mis à jour : 13/10/2025 08:00
politykazdrowotna







